Basic HTML Version

I primi modelli atomici
UNITÀ
C1
5
Fu il fisico inglese
Joseph John Thomson
, nel 1897, ad attribuire il nome di
elettroni
alle particelle che costituivano i raggi catodici.
Il tubo di Crookes si è evoluto nel corso del secolo scorso, dando origine al tubo
a raggi catodici (o tubo catodico), che per lungo tempo è stato il costituente
fondamentale dei televisori e dei monitor per computer (
Figura 8
).
3. Massa e carica degli elettroni: prime misure
Nel 1897, Thomson, misurando le deviazioni che subivano gli elettroni in cam-
pi elettrici o magnetici di intensità nota, fu in grado di determinare il rapporto
tra la loro carica (
c
) e la loro massa (
m
). Il valore sperimentale trovato non si
discosta molto da quello attualmente accettato, che vale 1,75
?
10
8
C
/g . Poi-
ché tale valore si manteneva costante qualunque fosse il materiale di cui era
costituito il catodo e il tipo di gas che riempiva il tubo, Thomson concluse che
gli elettroni dovevano essere costituenti fondamentali della materia.
Convinzione avvalorata anche da altre scoperte:
sono elettroni le particelle emesse da metalli colpiti da luce di particolare
lunghezza d’onda (
effetto fotoelettrico
, spiegato poi da Einstein nel 1905);
sono elettroni le particelle emesse dai metalli scaldati ad alte temperature
nel vuoto (
effetto termoionico
);
sono elettroni i costituenti dei raggi
b
(un tipo di emissione radioattiva nor-
malmente presente in natura).
Gli studi sul passaggio della corrente elettrica nelle soluzioni avevano consen-
tito intanto di stabilire che, in soluzione, l’atomo di idrogeno è presente sotto
forma di ione positivo, con carica elettrica di valore uguale, ma segno opposto
a quella dell’elettrone. Si era potuto misurare anche il rapporto carica/massa
per tale ione e, confrontatolo con quello dell’elettrone, si concluse che:
la massa dell’elettrone è 1837 volte più piccola della massa dell’atomo di idrogeno.
La scoperta che l’elettrone è una particella di massa molto inferiore a quella
del più piccolo atomo esistente (
Figura 9
) dimostrava che:
l’atomo non può essere considerato come la parte più piccola, non ulteriormente di-
visibile, della materia.
La carica dell’elettrone poté essere determinata nel 1911, dal fisico statuniten-
se Robert Millikan. Essa risultò valere
-
1,602
?
10
-
19
C. Poiché tale carica era la
più piccola fino allora determinata, venne considerata come la carica elettrica
elementare (
e
), con valore convenzionale
-
1. Pertanto:
l’elettrone è definito come una particella di carica unitaria negativa.
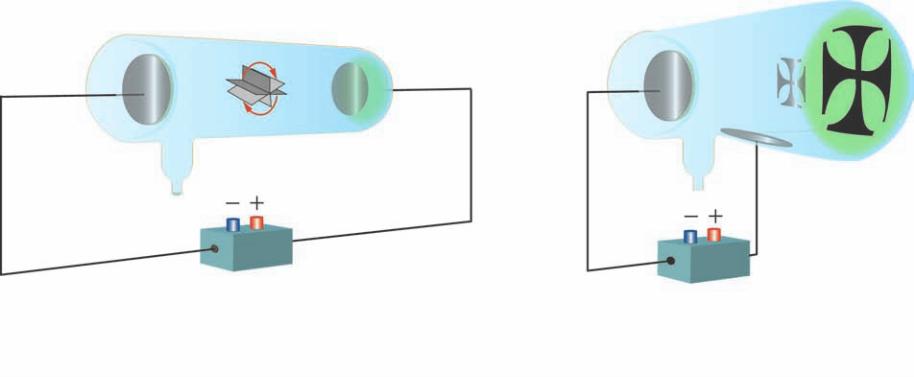
Figura 7
I raggi catodici mettono in movimento
un mulinello, ma non attraversano la
materia.
Figura 8
Per tutto il XX secolo i monitor più
diffusi utilizzavano un tubo catodico,
evoluzione del tubo di Crookes.
Figura 9
L’elettrone è una particella subatomica
1837 volte più piccola dell’atomo di
idrogeno.
catodo
catodo
anodo
anodo
Il
Coulomb (C)
è l’unità di misura
della carica elettrica nel Sistema
Internazionale.
H
e
Come si spiegano
questi numeri?
Test
Cruciverba
eBook
Mappa
Flashcard
Audio
Videolaboratorio
Animazione
Classe virtuale
Atlante
Linea del tempo
E-commerce
Glossario
Lezione LIM
Tutorial
Lettura
Documento
Biblioteca
XII1-029_U07_C1_Chimica_Tottola_CS4-sec imp.indd 5
12/12/11 1

